Erstmalig konnten die bereits beim ASH 20221 und beim EHA-EBMT CAR-T-Kongress in Rotterdam präsentierten Daten auch bei der ÖGHO-Frühjahrstagung 2023 der hämatologischen Community präsentiert werden. 2019 wurden im Rahmen der Gründung des österreichischen CAR-T-Netzwerks, bestehend aus 6 CAR-T-Zentren (AKH Wien, St. Anna Kinderspital, Medizinische Universitätsklinik Graz, Elisabethinnen Linz, Paracelsus Medizinische Universitätsklinik Salzburg, Universitätsklinik Innsbruck – vom Osten zum Westen aufgezählt), die Richtlinien für die kommerzielle CAR-T-Zelltherapie des relapsierten/refraktären großzelligen B-Zell-Lymphoms in Bezug auf mehrere Aspekte reguliert: Es wurde ein landesweit geltendes Positionspapier formuliert, welches das CAR-T-Zentrum definierte2, die Vorgehensweise der Patientenauswahl gemäß eines konsensuell definierten Algorithmus reguliert, unter Anwendung von Haupt- und Nebenselektionskriterien, und sich zum Ziel gesetzt, alle neuen Erkenntnisse im zeitlichen Verlauf in den Selektionsalgorithmus zu implementieren. Somit soll der Selektionsalgorithmus ein lebendiger und zeitangepasster Algorithmus bleiben. Damit wird gewährleistet, dass es zu keinem unnötigen Patiententourismus kommt, sehr wohl aber zu einem regen Austausch von Patienten in Hinblick auf die Möglichkeit der Studienteilnahme, da nicht in jedem CAR-T-Zentrum das idente Angebot an Studien vorliegen kann. In lokalen Tumorboards wird unter Anwendung des Selektionsalgorithmus und der Evaluation des vorliegenden Studienportfolios die bestmögliche Therapieentscheidung individuell für den einzelnen Patienten getroffen. Diese Patienten werden in einem gemeinsamen Register erfasst und nach Ablauf einer Zeitperiode von aktuell 3 Jahren einer gemeinsamen Analyse unterzogen.
Selektionsalgorithmus
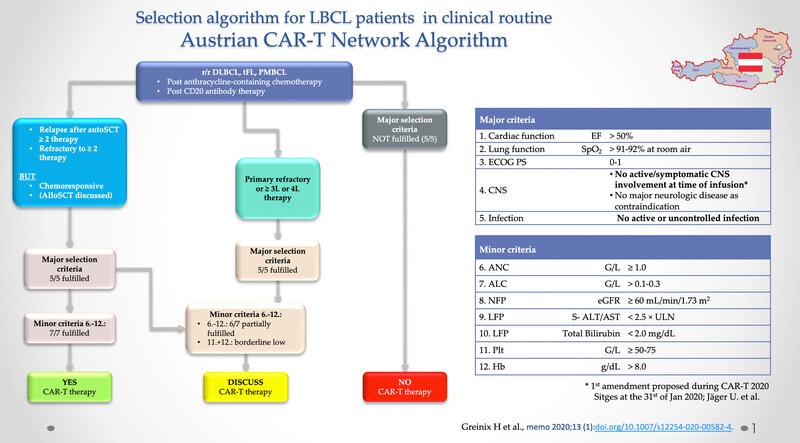
Der Selektionsalgorithmus beschreibt im Grunde drei Szenarien: eine absolute Befürwortung des als CAR-T geeigneten Patienten unter Erfüllung aller Haupt- und Nebenkriterien. Diese umfassen die wichtigsten Organfunktionen und damit die Komorbiditäten des Patienten und deren klinische Relevanz durch vorgegebene Richtwerte und durch die Nebenselektionskriterien weitere klinische Aspekte, die beispielsweise durch die Vortherapien hervorgerufen werden können (z.B. Hämatotoxizität, wobei dies indirekt die Knochenmarksreserve und somit letztlich auch die Machbarkeit eines Produktes reflektiert [Anzahl der absoluten Lymphozyten vor der Leukapherese], aber auch die LFPs und NFPs). Zeitgleich ermöglicht der Algorithmus aber auch die Definition eines Patienten, der durch Nichterfüllung der Hauptkriterien keinen geeigneten Patienten für eine CAR-T-Therapie darstellt. Als Beispiel ein herzschwacher Patient (Pumpfunktion mit einer EF < 50 %) oder ein Patient, der einen aktiven Infekt durchlebt und somit ebenso nicht für eine CAR-T-Therapie mit potentiell auch schweren Nebenwirkungen wie cytokine release syndrome (CRS) oder neurologischen Nebenwirkungen (= ICANS – immune effector cell associated neurological toxicity syndrome) geeignet ist. Anfänglich war auch die ZNS-Beteiligung eine Kontraindikation für die CAR-T-Therapie in Anlehnung an die Zulassungsstudien von Kymriah® und Yescarta®. 3, 4 Bereits beim EHA-EBMT CAR-T Kongress 2020 in Sitges/Spanien wurde dieser dem Amendment unterzogen, sodass auch Patienten der Zugang gewährt werden sollte, die eine kontrollierbare ZNS-Manifestation aufweisen, in Anlehnung an die Zulassungsstudie „Transcend NHL001“ von Breyanzi® (Lisocabtagen maraleucel). 5, 6 Auf diese Weise wurde bereits sehr kurzfristig nach Präsentation des Netzwerks und des Selektionsalgorithmus dieses Amendment vorgenommen.